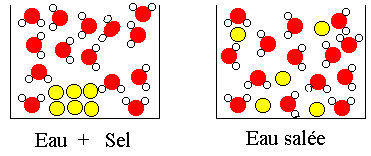
L'eau est un excellent solvant. De nombreux corps sont solubles dans l'eau et en grande quantité. Le produit qui se dissout est appelé le soluté. Le liquide obtenu s'appelle une solution.
On dit que le sel se dissout dans l'eau. Pour faire fondre du sel il faut le chauffer à 800°C.
1 La dissolution
Pourquoi ne le voit-on plus lorsque l'on dissout du sel ou du sucre dans l'eau ?
 |
Au départ le sel est visible car il est formé de nombreuses particules. Quand on agite, les particules se séparent et sont trop petites pour être vues. Les molécules d'eau entourent les particules de sel et les empêchent de venir se recoller ensemble |
Si l'on ajoute trop de sel dans l'eau, il ne dissout plus, car il n'y a plus assez de molécules d'eau pour séparer les particules de sel. La solution est saturée. On dit aussi que l'on a atteint la limite de solubilité du sel.
2 Conservation de la masse
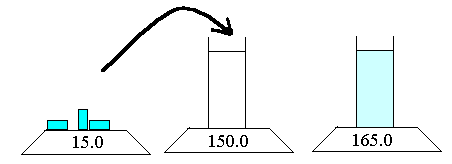
On ajoute 15g de sel dans une éprouvette pesant 150g pleine d'eau. Après dissolution la masse de l'eau salée et de l'éprouvette est de 165.0g = 15.0 + 150.0
La masse totale reste la même car si les particules de sel et d'eau se disposent différemment leurs nombres ne changent pas.
3 Concentration d'une solution
 |
Une solution contenant plus de sucre a plus de goût, elle est plus concentrée. Pour une solution colorée, la couleur est plus intense quand la concentration augmente. |
La concentration en g/l s'obtient en divisant la masse de corps dissous exprimée en g par le volume de la solution exprimé en litre.
![]()
Une concentration de 8g/l signifie qu'un litre de solution contient 8g de corps dissous.
Exemple : on dissout 0,2 kg de sel dans 500 mL d'eau.
On change d'unités : m = 0,2 kg = 200 g 500mL = 0,5 L
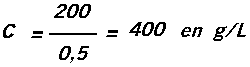
4 Dissolution du sel.
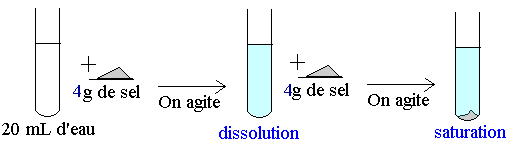
Si l'on ajoute 4 g de sel à 20 mL= 0,02 L d'eau, le sel se dissout entièrement.
La concentration de la solution C est = m/V = 4 / 0,02 = 200 g / L
Si l'on rajoute du sel, la solution se sature.
Un litre d'eau ne peut pas dissoudre plus de 360 g / L.
20 mL = 0, 02 L peut dissoudre 0,02 x 360 = 7,2g de sel.
Sur les 8 g de sel il reste 8 -7,2 = 0,8 g qui reste au fond du tube.
5 Cristaux de sel
| Quand on laisse évaporer de l'eau
salée on observe des cristaux de sel en forme de pyramide à degrés, ce qui est du à
l'empilement régulier des particules de sel. A droite une gravure de 1760 représentant des cristaux de sel vus au microscope. |
|
 |
6 Dissolution du sucre
La solubilité du sucre est de 2000 g/L à 20°C
La solubilité du sucre est de 4000 g/L à 80 °C
La température influence fortement la solubilité du sucre
7 Le sel, le sucre et la conservation des
aliments. 
| La présence d'une grande quantité de sel évite la prolifération des microbes et facilite la déshydratation des aliments. Depuis longtemps on a ainsi conservé des morues ou du lard salé. Le sucre est utilisé dans les confitures,La cuisson tue les micro-organisme et une grande concentration de sucre peut aussi ralentir la prolifération des micro-organismes. |
|
8 Tailles des particules de sel et de sucre
| La présence de chlorure de sodium peut être mise en évidences en plaçant un peu de solution dans une flamme bleue chauffante; Le sodium colore la flamme en jaune Le filtrat placé dans la flamme la colore aussi en jaune , ce qui montre que les particules de sel sont trop petites pour être arrêtées par les pores du filtre. |
|
|
Les particules de sucre traversent aussi les pores du filtre comme le prouve goût de sucre détecté dans le filtrat. On peut aussi montrer la présence de sucre en utilisant des bandelettes test dont le réactif change de couleur en présence de sucre. Ces bandelettes sont adaptées à la recherche de sucre dans les urines.
Mesure de la taille d'une particule.( lien vers mesure) |